|
(独)産業技術総合研究所は9月8日、北海道大学と共同で、近赤外線発光タンパク質を創り出すことに成功、これと医薬抗体とを結合させプローブ(探針)化することでがん細胞の位置を特定できる技術を開発したと発表した。
近年、生体内の抗体の動きをモニターする新しい技術として、生体を透過する波長範囲700~1,400nm(ナノメートル:1nmは10億分の1m)の光である近赤外線の利用が注目されているが、これまで実用レベルに達したものはなかった。
生体内の抗体とは、免疫反応を担う糖タンパク質のことで、特定の細胞(例えばがん細胞)を示す目印(抗原)を見つけると反応を起こして抗原を攻撃する抗体を医薬抗体という。
同研究所では、ウミホタルの発光系に着目し、糖タンパク質の一種「ウミホタルルシフェラーゼ」などを大量生産する方法を研究開発してきた。ルシフェラーゼは、生物発光反応を触媒するタンパク質の総称で、ウミホタルルシフェラーゼは、甲殻類ウミホタルにあるルシフェラーゼのこと。また、北海道大学や(株)リブテックと協力し、医薬抗体の一つである「DLK-1抗体」と発光タンパク質とを結合させた発光プローブの開発や、それを利用した肝がん細胞の可視化に取り組んできた。
近赤外線発光タンパク質は、ウミホタルルシフェラーゼの糖鎖(糖類が鎖状につながった構造の分子)に近赤外線有機蛍光色素を導入することで得られた。この蛍光色素は、生体内化学反応でエネルギーが移動することにより近赤外線を発するが、近赤外線は生体透過性が高いので、生体内部の近赤外線発光を外部から観測できる。このような近赤外線発光タンパク質は、これまで存在しなかった。
また、近赤外線発光タンパク質とDLK-1抗体とを結合させた近赤外線発光プローブで、マウスの体内に移植した肝がん細胞をCCDカメラでモニターできるようになった。
今回開発した近赤外線発光プローブは、化学反応で近赤外線を発光するので、外部から放射線や紫外線を当てる必要のないがん細胞評価法といえる。
同研究所では、今回開発した技術を様々な抗体に対して適用を試み、抗体治療薬の開発や病理ライブ診断など新しい医療技術への応用展開を目指すことにしている。
この研究成果は、9月7日(米国東部時間)に全米科学アカデミー紀要に掲載された。
詳しくはこちら
|
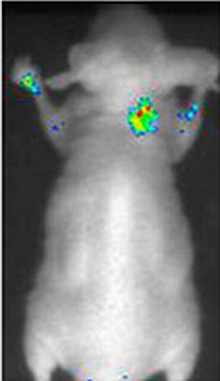 |
| 近赤外線発光プローブを注入した肝がん細胞移植マウスの画像。移植されたがん細胞の位置から近赤外線が出ている(提供:産業技術総合研究所) |
|
