(国)量子科学技術研究開発機構、鳥取大学などの研究グループは4月21日、歩行障害や手の震えなどを伴う進行性難病「パーキンソン病」発症の仕組み解明に新たな手がかりを得たと発表した。脳内タンパク質の線維化が発症に深く関わっているとされているが、今回初めて線維化したタンパク質内部の原子が異常な動き方をしていることを発見した。今までにない新しい治療薬の開発につながると期待している。
研究グループには大阪大学と日本原子力研究機構などが運営するJ-PARCセンター、(一財)総合科学研究機構も加わった。
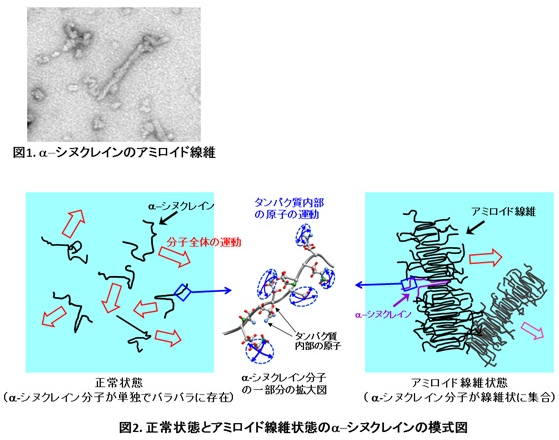
パーキンソン病は50~60歳代で多く発症する脳神経の難病。患者の脳細胞には神経伝達を助けるタンパク質「α-シヌクレイン」が集合したアミロイド線維が多く見られるため、この線維化が発症のカギを握っているとみられている。ただ、アミロイド線維が脳内でどのように形成されるかは未解明だった。
研究グループは、大腸菌に作らせたタンパク質のα-シヌクレインを利用して人工的にアミロイド線維を作り、それらが単独でバラバラに存在している正常状態と、集合してアミロイド線維になったときの性質を詳しく調べた。分析にはタンパク質内部の原子のゆらぎ運動の状態も調べることができる中性子準弾性散乱実験という手法を用いた。
この結果、タンパク質全体の運動はアミロイド線維よりも正常状態の方がかなり大きかったのに対し、タンパク質内部の原子の運動に注目すると反対にアミロイド線維の方が大きくなっていた。原子のゆらぎ運動の大きさは正常状態が0.4nm(ナノメートル、1nmは10億分の1)程度だったのに対し、アミロイド線維では0.6nm程度。タンパク質全体の運動は小さいのに、内部の原子は反対に大きく運動するというと異常な振る舞いをしていることがわかった。
研究グループは「α-シヌクレインはアミロイド線維中の方がむしろ安定であり、アミロイド線維形成が自然に進む可能性を示唆している」として、線維形成の仕組み解明に役立つとみている。アミロイド線維はアルツハイマー病などにも関係するため、これらの病気発症の根本的な解明につながる可能性もあるという。